研究内容
量子生物学
「量子生物学」とは?
「私が言おうとしてきたことは、量子力学が生物的現象に無縁ではないこと、しかし、量子力学の与える光明は、物理化学と固体物理学とから反射され
た、間接の照明であるということである。生物学者
の前に立ちはだかる現象の大部分は、無生物物質に起こる現象と本質的に違ったものではなく、複雑さの点だけで違っているものである。従って通例は、純粋に
量子力学的な議論にふけるよりも、簡単な物理的類例を探すほうが実り多いであろう。これは、分光学的測定の理論的背景を与えるという点での量子力学の重要
性を否定するものではないが、我々は、「量子力学的効果」を云々することによって、いとも容易に創り出される神秘の気を払い除けるのに注意深くあらねばな
らない。」
(H.C. Longuet-Higgins ― 第1回生物物理学国際会議(1961年、ストックホルム)にて)
はたして生命現象の記述に量子力学は必要でしょうか?「Yes」と即答される方はすぐに以下のような事例を挙げられます。植物や視物質による光吸 収・応答、光合成や呼吸等に関わる電子伝達系・エネルギー移動、酵素反応やATPの関わる化学反応、リガンド結合に伴う分極や電荷移動、DNAにおける電 子移動・電気伝導などなど。しかしながら、これらの「メカニズム解明」に用いられる理論的な道具立ては、比較的小さな「無生物」分子系に対して用いられる ものと本質的な差があるでしょうか?我々は単に、生物・生命系の「無生物的な」一部を切り出してきて「物理化学」や「量子化学」を行っているだけではない でしょうか?だとすると、我々の生命現象の記述は、いわばこうした「量子力学的なピース」を組み合わせた「古典力学的な描像」で事足りることになります。 量子力学的に算出された力場を用いた蛋白質や核酸に対する古典分子動力学法より上の階層の「くりこまれた」古典的世界のモデルで基本的には十分ということ になり、バンド理論やフェルミ縮退、超伝導などが幅を利かす固体電子論とは大きな差異があります。このままでは、「量子生物学」の名に真に値する量子生物 学は存在しない と言っても過言ではありません。
「量子生物学」は存在するか ?
もし仮に「量子生物学」というものが存在するならば、それは対象とする生命現象の記述にとって量子力学が「本質的な」役割を演じるものでなければな
りません。例えば、量子コヒーレンスや電子相関といった効果が生物機能と密接かつ直接的に関係しているような事例(逆に言うと、「くりこまれた古典マクロ
(粗視化)モデル」が存在しないような事例)が見つかれば、そこに「量子生物学」が存在することになります。
過去において、生命現象の記述にとっ
て量子力学的効果が本質的な役割を果たすことを標榜したモデルもいくつか提案されてきました。しかしながらそれらの多くは何らかの「現象」に対してad
hocに量子力学的な方程式を書き下すことから出発するもので、サイエンティスト全員が首肯できる共通の出発点(即ち、原子核・電子系に対するシュレディ
ンガー方程式)に基づくものではありませんでした。一方、多電子系に対するシュレディンガー方程式に立脚して生命現象の量子性を抽出しようとする「謙虚
な」アプローチには、これまで「計算規模」と「計算精度」という大きな壁が立ちふさがってきました。例えば、化学反応性の記述などの目安となる
「Chemical Accuracy」を保つためには系全体のエネルギー計算の精度を室温(kT = 300K = 0.6
kcal/mol)の数倍程度以下に抑える必要がありますが、電子1個あたりのエネルギーのおおよその大きさは 1 hartree = 627
kcal/mol程度あり、1個の蛋白質の中にはこれらの電子が通常1万個以上含まれています。「量子生物学」の第一歩において、我々はこの「生体高分子
に対するシュレディンガー方程式を化学的精度で解く」という難問を解決する必要があります。
参考文献
- 「量子生物学-分子下生命像は解けるか」(大木幸介、講談社ブルーバックス、1969)
- 「新しい量子生物学-電子から見た生命のしくみ」(永田親義、講談社ブルーバックス、1989)
- 「量子生物学の展開」(田中成典、パリティ 26, No. 7 (2011) pp. 12-18)
- 「量子生命科学の展望」(田中成典、実験医学 Vol. 35, No. 14(9月号)(2017)pp. 2423-2427)
量子と生命
量子生物学あるいは量子生命科学における一つの保守的なアプローチとして「量子システム生物学(Quantum Systems Biology)」があります。以下で紹介する「光合成系のシステムバイオロジー」はその典型的な一例です。関係する生体分子に対する第一原理的な電子状 態計算から出発して、各種化学反応ダイナミクスにおける速度定数を見積もり、反応ネットワークに対する多変数連立の速度論的方程式系を解いて、マクロな生 体機能のボトムアップ的な記述を目指します。
このような比較的オーソドックスなアプローチに加え、近年では「量子」と「生命」のより広い視野からの関係性の探索が進められています。以下で紹介 する「生命の起源」問題においても、約40億年前の地球上でいかに無機的な「物質」から「生命システム」が誕生したのかを考えるにあたり、情報論・計算論 的な観点から、「生命的なもの」と「量子的なもの」のより密接な関係が議論されつつあります。
参考文献
- 田中成典「計算分子生物学:物質科学からのアプローチ」(内田老鶴圃、2018)
- 田中成典「生体分子夾雑系の理論計算化学:分子論から生命論へ」、現代化学 No. 579, 47-51 (2019)
光合成系のシステムバイオロジー
植物や細菌に見られる光合成系は「生命とは何か?」を考える上で重要なプロトタイプと見なせ、その機能メカニズムの解析・解明は計算生物学における 数多くの課題を提供してくれる。図1に葉緑体中のチラコイド膜に埋め込まれた光合成装置の概略図を示すが、この全体の機能を理論モデルで再現するシミュ レータの作成はシステムバイオロジーの重要なテーマの一つである。
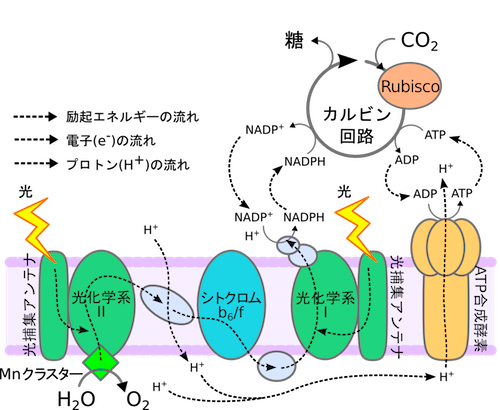
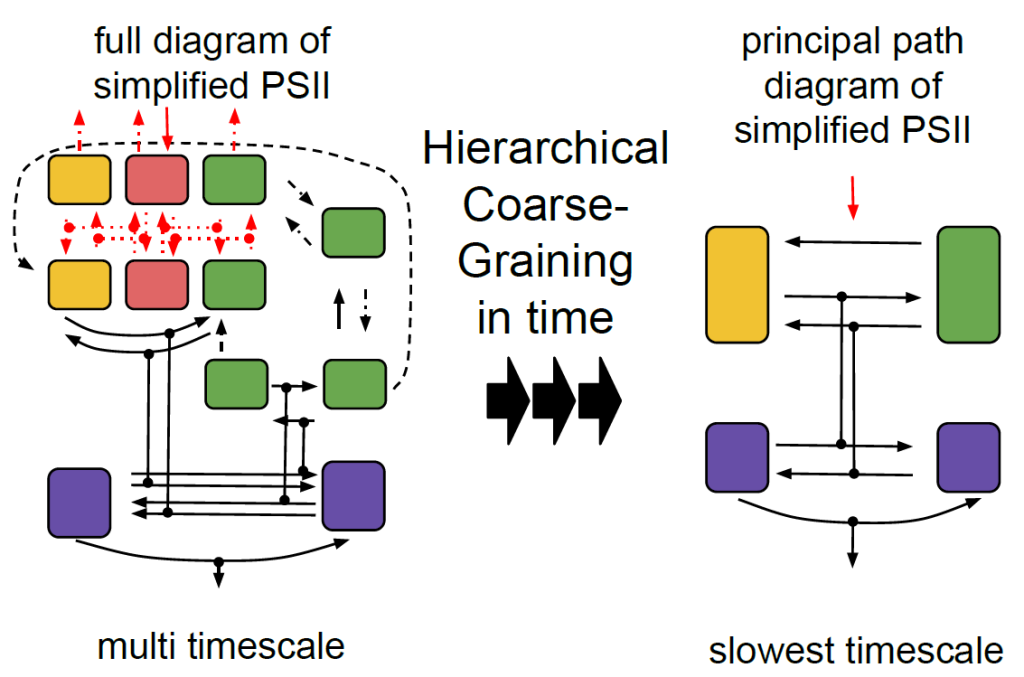
我々のグループでは、光化学系I(PS I)や光化学系II(PS II)で観察される励起エネルギー移動や電子移動の素過程を分子レベルから解明する微視的な理論モデリングに加え、PS IやPS IIのシステム全体の光応答を記述するマクロな動的シミュレーションも行っている。系全体のダイナミクスを反応速度論的微分方程式のセットとして取り扱う 際の問題点は、変数の多さよりもむしろ、含まれる反応の時定数が幅広い(場合によっては10桁以上の)時間スケールに亘る点である。そのため、最も速い素 過程に対応した短い時間ステップで全てのプロセスを積分するには膨大な計算コストを必要とする。我々はこの困難を克服するために、速い時間スケールから遅 い時間スケールに向かって階層的にモデルの粗視化(くりこみ)を行う理論手法を開発し、それをPS I、PS IIに適用することで、フェムト秒からピコ秒スケールの高速の素過程を含む系のミリ秒以上の時間レンジでの光反応ダイナミクスを実験・観測事実と整合的に 記述することに成功した(図2参照)。
参考文献
- S. Tanaka, R.A. Marcus, J. Phys. Chem. B101 (1997) 5031.
- S. Tanaka, E.B. Starikov, Phys. Rev. E 81 (2010) 027101.
- Y. Suzuki, K. Ebina, S. Tanaka, Chem. Phys. 474 (2016) 18.
- T. Matsuoka, S. Tanaka, K. Ebina, BioSystems 117 (2014) 15.
- T. Matsuoka, S. Tanaka, K. Ebina, J. Theor. Biol. 380 (2015) 220.
- T. Matsuoka, S. Tanaka, K. Ebina, J. Photochem. Photobiol. B: Biology 160 (2016) 364.
フラグメント分子軌道(Fragment Molecular Orbital, FMO)法
1.FMO法とは・・・
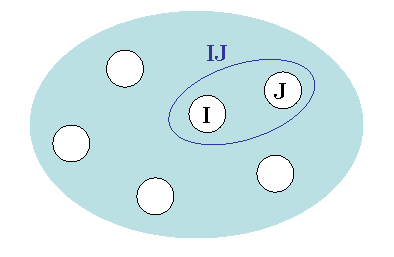
分子や分子集合体を適当なサイズのフラグメントに分割し、フラグメントとフラグメントペア(図1)について非経験的(ab initio)分子軌道(Molecular Orbital, MO)計算を行うだけで、分子全体のエネルギーや電子密度を計算する方法
分子の全電子エネルギー
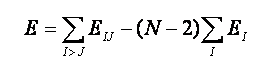
フラグメント・・・N個
フラグメントペア・・・[N(N-1)/2]個
2. FMO法の特徴
・低分子化合物で成功を収めたab initio MO法を、精度を落とさずにタンパク質やDNAのような巨大分子へ適用することが可能(図2、3)
・モノマーおよびダイマーの計算は独立して行うことが可能なため、並列化が容易であり、大幅な高速化が可能
・ FMO計算から得られるフラグメント間の相互作用エネルギーを用いることにより、従来困難であった残基―リガンド分子間の相互作用等を定量的に解析することが可能
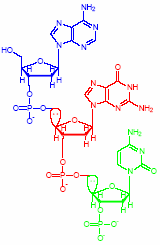
(n残基単位)

参考文献
- S. Tanaka, Y. Mochizuki, Y. Komeiji, Y. Okiyama, K. Fukuzawa, Phys. Chem. Chem. Phys. 16 (2014) pp. 10310-10344.
インシリコ創薬
現在、一つの薬を上市するのに10年以上の研究開発期間と1000億円以上の研究費が必要とされている。これらの負担を軽減するために、計算機技術を活用した「インシリコ(in silico)」創薬に期待が集まっている。
コ
ンピュータを活用して創薬を加速する第一のポイントは、膨大な化合物データベースの中からターゲットタンパク質に最も良く結合する候補分子を効率的に探
索・設計することである。そのために、数々のドッキングソフトウェアや計算機シミュレーション技術が開発されている。中でも、定量的な正確さとある程度の
高速性を兼ね備えた手法として、古典力場に基づく分子動力学(Molecular Dynamics;
MD)法がしばしば用いられている。これによるリガンド分子とターゲットタンパク質の間の結合自由エネルギー計算は現在インシリコ創薬の一つの主流となっ
ている。
一方、古典MD法で用いられる力場には経験的な要素が多く、ドラッグデザインにおける実用性の点でもその改善が求められている。計算化学
的にこれを超える道筋は第一原理的な量子化学計算に依拠することであり、フラグメント分子軌道(Fragment Molecular Orbital;
FMO)法の利用はその解の一つである。我々は「 FMO創薬コンソーシアム」の活動を通して、産官学連携で、FMO法をベースとした薬剤探索・設計手法の開発を進めている。
FMO
法によれば、タンパク質-リガンド分子結合系におけるリガンド-アミノ酸残基間の実効相互作用をフラグメント間相互作用エネルギー(Inter-
Fragment Interaction Energy;
IFIE)の形で定量的に求めることができる。様々なリガンド分子に対して得られたIFIEの値を情報科学的に分析することで、ドラッグデザインのさらな
る加速が期待できる。
参考文献
- S. Uehara, S. Tanaka, Molecules 21 (2016) 1604.
- S. Uehara, S. Tanaka, J. Chem. Inf. Model. 57 (2017) 742.
- R. Kurauchi, C. Watanabe, K. Fukuzawa, S. Tanaka, Comput. Theor. Chem. 1061 (2015) 12.
核内受容体
・特徴
1つの遺伝子スーパーファミリーを形成しており、このファミリーに属するレセプターは構造と機能が極めて類似している。
・機能
リガンド誘導性転写制御因子として機能することで、標的遺伝子群の発現を転写レベルで制御する。(リガンド‥‥ホルモン, ビタミン, エイコサイドなど)
・機構
核内レセプターがリガンド依存的に転写を促進するとき、リガンドの結合によるレセプター自身の構造変化と、それに伴う一群の共役転写因子群との相互作用が必須であり、この相互作用の制御がリガンドの活性を規定するということが明らかにされつつある。
参考文献
- M. Ito et al., J. Phys. Chem. B 112 (2008) pp. 12081-12094.
計算機シミュレーションによるRNA結合タンパク質の塩基配列特異的認識機構の解明
RNA結合タンパク質(RBP)とは、特定の配列や構造をもつRNAに結合し、安定化や分解、翻訳調節、細胞内局在といった機能を発現するタンパ ク質の総称である。ヒトゲノムの解析から、コードされている遺伝子の約1%はこのRBPであることが報告されており、生命維持のみならず、学習記憶等の高 次機能に関与することや、発現異常が重篤な疾病の原因となるなど、生命現象において重要なタンパク質グループの一つであることが知られている。これまで、 実験により様々なRBPの標的配列や、標的RNAとの結合定数が決定されており、また100種類以上のRBPの立体構造も解かれている。これらの結果か ら、結合界面の構造や結合定数によるRNAの”静的な”特徴づけが行なわれてきた。
さらに近年、NMRの技術進歩や計算機資源の充実に伴う巨大分子の分子動力学(MD)計算が可能になったことにより、分子間、内の協同運動などのタ ンパク質-RNA複合体の”動的な”性質の研究が報告されるようになった。一方、フラグメント分子軌道(FMO)法により、生体高分子を直接量子化学計算 することも可能になった。本研究では、先行研究から得られた知見を踏まえ、計算機シミュレーションを用いてRNAの特異的認識を物理化学の観点から明らか にすることに挑戦している。
参考文献
- I. Kurisaki, K. Fukuzawa, T. Nakano, Y. Mochizuki, H. Watanabe, S. Tanaka, J. Mol. Struct.: THEOCHEM 962 (2010) pp. 45-55.
- I. Kurisaki, H. Watanabe, S. Tanaka, Protein Peptide Lett. 17 (2010) pp. 1547-1552.
ポリグルタミン(polyQ)タンパク質凝集の分子シミュレーション
ポリグルタミン(PolyQ)病は原因遺伝子内のグルタミンをコードするCAGリピート配列の異常伸長という共通の遺伝子異常により発症する遺伝性 神経変性疾患の総称である。Qの繰り返し数が37を超えると、PolyQタンパク質が核となってタンパク質のミスフォールディングが生じ、神経変性をきた すと考えられている。
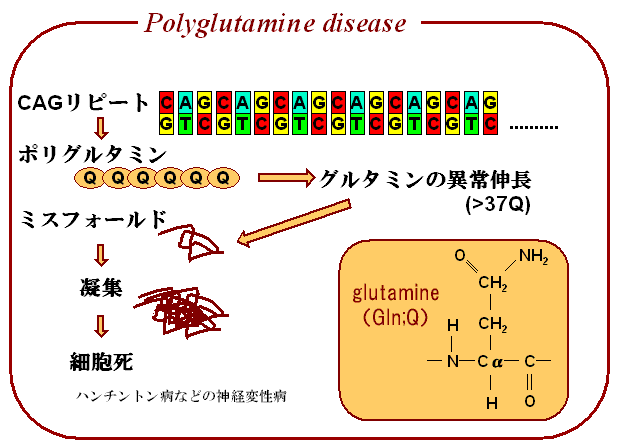
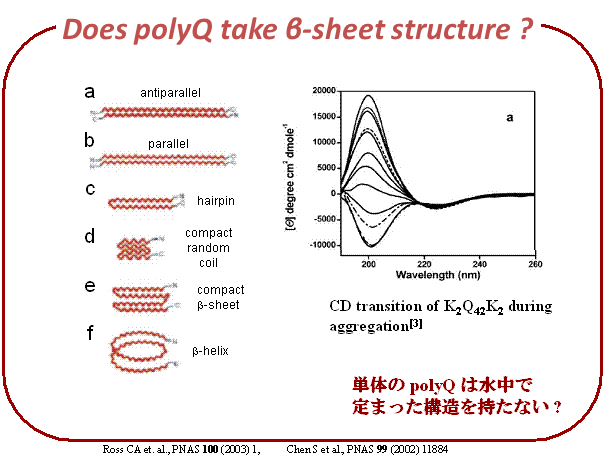
polyQタンパクは、いくつかの実験事実から水中ではβシート構造をとると考えられているが、その詳細な構造は明らかにされていない。また、単体のpolyQは定まった構造をとらないという議論もある。
本研究では、PolyQタンパク質の溶媒中での動態をコンピューターシミュレーションを用いて解析することで、PolyQ凝集体形成のメカニズムの解明を目指している。
参考文献
- M. Nakano, H. Watanabe, S.M. Rothstein, S. Tanaka, J. Phys. Chem. B 114 (2010) pp. 7056-7061.
- M. Nakano, K. Ebina, S. Tanaka, J. Mol. Model. 19 (2013) pp. 1627-1639.
生命の起源
A. 生命の起源研究の段階
生命の起源研究は、地球上が鉱物などの無機物で占められた冥王代の「非生命的環境」から如何にして現生命につながる原始的生命が誕生したか、を探求 する学問である。時系列に基づいて下に挙げるようにいくつかの段階があるとされ、これら段階ごとに研究が進められることが多い。
- 1. CO2等の非還元的分子が支配的であった冥王代当時の苛酷な環境から、生命誕生に適した還元的環境にどのようにして移行したか?
- 2. 還元的環境下のNH3やHCOOH等の還元的窒素・炭素源分子から、アミノ酸や核酸塩基などの現生命のbuilding blocksが選択された理由とは?
- 3. (アミノ酸等が選択された理由にも関係するが)、アミノ酸・核酸塩基等がタンパク質やDNA/RNAといった情報分子に至った過程とは?
- 4. (上の3項目とは飛躍があるが)、知性・意識の起源の説明。
当研究室では、「1.」の段階に関してまず取り組んだ。
B. 隕石衝突に基づく地球生命の起源仮説
「隕石衝突に基づく地球生命の起源仮説」[1] を提案した先行研究は、原初地球に降り注いだ純鉄を含む隕石が苛酷な環境下でも多種かつ多量の還元的分子の生成をもたらしたと主張する。当仮説に対する検証実験も今日までに多々行われており、CO2やN2からアミノ酸の他に「核酸塩基」の生成も確認されている。隕石衝突が原初地球の非還元的環境を「破壊」して還元的環境を提供した、と述べる本仮説は実験的検証も相まって真実味を帯びてきている。
C. 大規模量子シミュレーションによる仮説の理論的検証
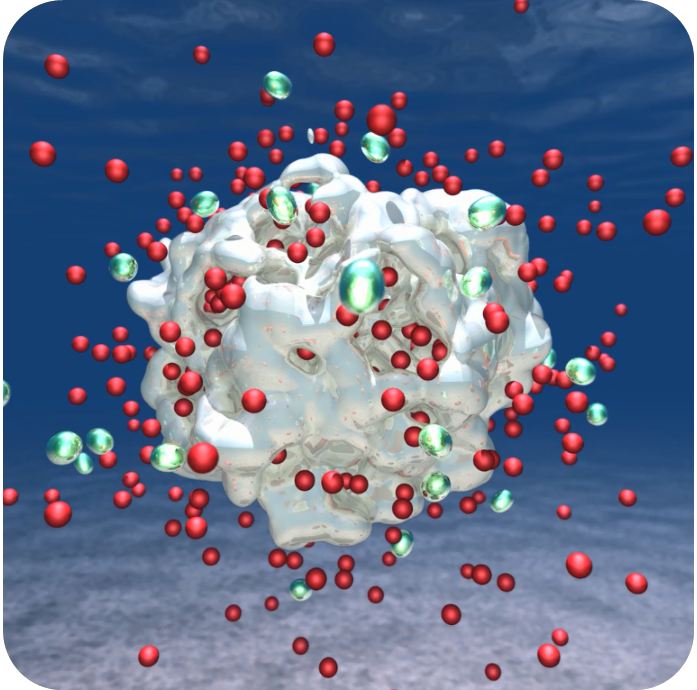
一方で、検証実験では生命を構成する全てのアミノ酸・核酸塩基等のbuilding blockの生成が見られたわけではない。そのため、残りの分子の生成へ至る手がかりを得るためにも生成過程を明らかにしたい。ただ、実験的に原子レベル での解析が困難であるのに加え、莫大なエネルギーを伴う実際の隕石衝突を完全に模擬するのは不可能である。このため、私たちは大規模量子シミュレーション を用いて形成過程の理論的な調査を行った。アミノ酸等の基本的な生体有機分子は10~30個の原子から作られており、このような比較的大きな分子を扱う場 合には量子計算系はできるだけ大きな原子数から成るものを用意しなければならない。一般的にこれは極めて困難であるが、私たちは新手法 [4] を生かした計算機シミュレーションを行い、この課題に取り組んだ。
参考文献
- [1] 中沢弘基、「生命誕生:地球史から読み解く新しい生命像」(講談社現代新書、2014).
- [2] Y. Furukawa, et al., Earth Planet. Sci. Lett. 429, 216 (2015).
- [3] Y. Furukawa, et al., Nature Geosci. 2, 62 (2009).
- [4] K. Shimamura, et al., Nano Lett, 14, 4090 (2014).