|
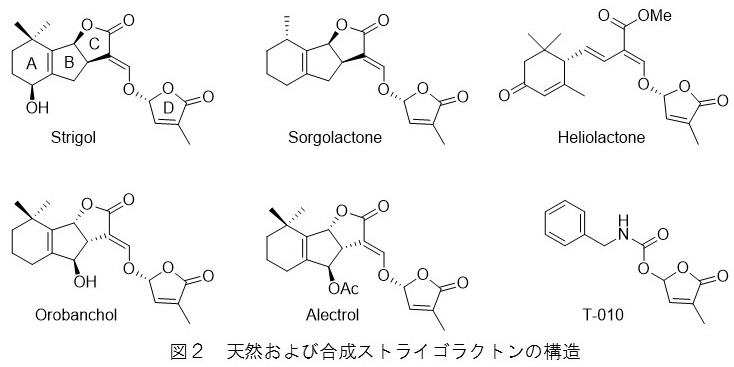
根寄生雑草と宿主作物の最初の直接的な関係に関与し、根寄生植物の生存戦略の重要な要素となる発芽刺激物質について、私たちを含めて多くの研究者によって、単離、構造決定、構造活性相関などの化学的解明が進められてきました。ワタはストライガの宿主ではありませんが、根滲出液がストライガの発芽を誘導し、ワタを混植するとストライガによる宿主作物への被害が軽減されることが経験的に知られていました。そのため最初に構造が明らかにされた発芽刺激物質strigol(図2)とそのアセチル体は、宿主植物ではなくワタの根滲出物から単離されました。Strigolは結晶として得られたため、X線結晶解析によって構造が決定されました。1990年代になって、strigolと類似の構造を有するsorgolactoneとalectrolがそれぞれストライガの宿主植物であるソルガムとササゲの根滲出液から相次いで単離され、strigolを含めてストライゴラクトン(strigolactone, SL)と総称される化合物群が、自然界でストライガの宿主認識に関わる発芽刺激物質であることが認知されました。SLはストライガのみならずオロバンキの発芽をも誘導することから、オロバンキの発芽にも関わっていると推測されていました。このことはオロバンキの宿主であるアカクローバーの根滲出液からorobancholが単離されたことで実証されました。SLは化学的に不安定であり環境中で速やかに分解されます。このことは,宿主の根のごく近傍にある種子だけが発芽し、遠く離れた種子は発芽しないという、根寄生雑草の生存戦略を支える要因となっていると考えられますが、結果として単離される量が僅少であったため構造の確定は困難をきわめました。それぞれのSLの構造は、推定構造に基づいて合成された化合物との機器分析データの比較、および、必要に応じて,発芽刺激活性の比較によって確定されました。私自身は1996年に当時の文部省からオランダのナイメヘン大学に派遣され、Binne Zwanenburg教授の研究室でsorgolactoneの推定構造に基づき全8種の立体異性体の合成を行い、天然物の構造を決定しました(図2)(Sugimoto et al. 1998)。また、神戸大学に異動してから、確定していると考えられていたorobancholおよびalectrolの構造に矛盾を見出し、それぞれを再度単離し、真の構造を明らかにしました(図2)(Ueno et al. 2011)真の構造にたどり着くまでの取り組みを、総説に著しました(上野ら 2013; Ueno et al. 2015)。ご一読いただき、植物天然物化学のおもしろさを感じていただけたら幸甚です。
今までに20種近くのSLが単離構造決定されていますが,それらの多くはA, B, C環から成る三環性ラクトン部分にエノールエーテル結合を介してブテノライド(D環)が連結した基本骨格を有しています。これらは、strigolと同じ立体化学を有する化合物群とorobancholと同じ立体化学を有する化合物群に大別されます。構造の多様性は、基本骨格のA環やB環に水酸基、メチル基、アセトキシ基、エポキシ基、ケトン基等の導入によってもたらされています。最近、これらはcanonical SLと呼ばれることもあります。その理由は、A, D環はあるもののB, C環が開裂した構造を有する発芽刺激物質が見出されてきていることによります。私たちもそのような発芽刺激物質として、ヒマワリが生産分泌するheliolactone(図2)を発見しました(Ueno et al. 2014)。
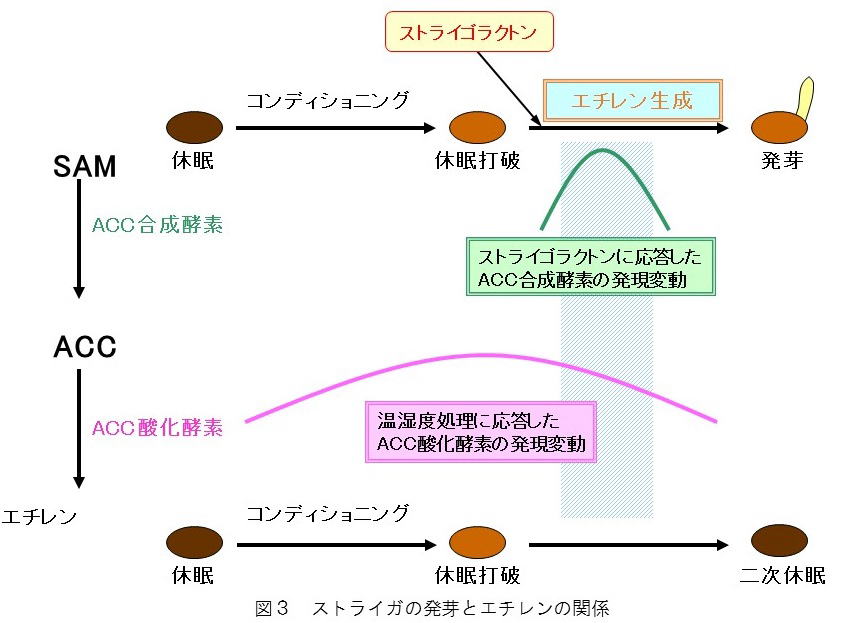
天然の発芽刺激物質とその類縁体は、S. hermonthicaおよびS. asiaticaの種子中のエチレン生合成を通して発芽を促進していると考えられています(Babiker et al. 2000)。私たちは,S. hermonthicaの種子中ではコンディショニング中に1-aminocyclopropane-1-carboxylic acid(ACC)酸化酵素遺伝子の発現が高まり,そこに発芽刺激物質を与えると10時間以内にACC合成酵素遺伝子の発現が促進された結果,エチレンの生成が活性化し,発芽につながることを明らかにしました(Sugimoto et al. 2003)。このことは、環境要因と近傍の宿主の存在を、エチレン生合成を担う二つの遺伝子の発現に反映させる、ストライガの巧みな生存戦略と考えられます(図3)。エチレンはオロバンキの発芽には関わっていないと考えられる知見も得ています(Sawada et al. 2012)。
|

